
核苷(酸)类似物[NAs]和/或聚乙二醇干扰素α(PEG-IFN-α)为当前国际指南推荐的乙型肝炎(以下简称乙肝)抗病毒药物,NAs治疗可实现持续的HBV DNA抑制,使肝组织病理学改善,并减少终末期肝病,但不能完全杜绝肝癌的发生。NAs往往需长期用药,因为NAs联合或不联合PEG-IFN-α在初治乙肝患者中的HBsAg血清转阴率仅为0~9%。故此,乙肝功能性治愈仍为全球迫切需要解决的难题。距离首个NAs药物上市已过去近30年,当前全新机制的乙肝抗病毒药物及免疫调节剂在早期临床试验中终于展现出初步疗效,尤其是小核酸新药显著提高了乙肝功能性治愈率,使乙肝治愈之光照进现实。
1小核酸药物使严格定义的乙肝功能性治愈成为更普遍的现实
1.1 功能性治愈是乙肝新药研发的主要终点
HBV感染自然史的相关研究提示,HBV DNA水平是肝细胞癌(HCC)发生的最相关因素之一。NAs治疗下HBV DNA的抑制率未能达到100%,NAs治疗后更早更快地实现HBV DNA抑制可能有助于减少肝脏事件的发生,以HBV DNA抑制为目标的乙肝新药仍有开发的空间。然而,仅HBV DNA持续抑制尚不能完全满足临床需要,接受NAs长期治疗的人群仍有HCC发生,HBsAg转阴可进一步降低HBV DNA抑制人群的HCC风险。因此,HBsAg转阴是乙肝抗病毒治疗的理想终点。经过间隔至少6个月的两次检测确认HBsAg转阴,后续可有较高的概率长期持续HBsAg阴性。因而目前认为,乙肝新药Ⅱ/Ⅲ期试验的主要终点为功能性治愈,即HBsAg转阴且HBV DNA小于定量检测下限并持续至结束治疗后24周。我国药品监管部门对于有限疗程的新药确证性临床试验同样提出严格的功能性治愈终点,即有限疗程结束后,所有药物停止治疗6个月或更长时间后,HBV DNA与HBsAg均低于定量检测下限。现有的NAs加用PEG-IFN-α联合治疗在特定的优势人群可有一定的功能性治愈率。功能性治愈是可及的终点,也是通过减少疾病进展与HCC发生从而提高生存率与生活质量的治疗目标的替代终点。
针对HBV生命周期不同阶段的乙肝新药,如钠离子-牛磺胆酸共转运蛋白抑制剂(针对HBV进入)、衣壳组装调节剂、核酸聚合物、RNA干扰等小核酸类药物(针对病毒复制及病毒蛋白表达)、HBV共价闭合环状DNA(cccDNA)抑制剂、基因编辑(针对HBV cccDNA生成及加工),以及恢复或提高宿主HBV特异性免疫应答的免疫调节剂等,在临床前研究均产生不同程度的HBsAg下降,部分新药在早期临床试验中获得与临床前研究一致的效果。其中,小核酸新药治疗过程中HBsAg水平下降及HBsAg转阴率尤为突出,成为乙肝功能性治愈的新基石。
1.2 引领未来的小核酸机制为乙肝新药研发带来希望
小核酸药物通过前体信使核糖核酸(pre-mRNA)或信使核糖核酸(mRNA)的碱基互补配对作用,干扰目标基因的表达,从而发挥治疗作用(表1);或者通过三维结构形成与蛋白质相互作用,进一步干扰其功能。小核酸药物由几十个核苷酸串联组成短链核酸,包括各种类型的核酸,其中反义寡核苷酸(ASO)和小干扰RNA(siRNA)在众多乙肝新药研发中进展最快。
Bepirovirsen(GSK3228836)作为一种靶向全部HBV mRNA的嵌合型2'-甲氧乙基修饰的硫代磷酸ASO,是当前最早且唯一进入Ⅲ期试验的乙肝新药。Bepirovirsen与HBV产生的所有4种mRNA和前基因组RNA中存在的20个核苷酸延伸互补,其结合位点位于前核心、核心和表面抗原(前S1、前S2和S)编码序列的下游,以及聚合酶和X蛋白的编码序列内。Bepirovirsen通过Watson-Crick碱基配对与RNA结合,与同源RNA的杂交(结合)导致核糖核酸酶H(RNase H)介导的RNA降解,从而阻止RNA翻译蛋白的生成。
Xalnesiran(RG6346,RO7445482)是一种N-乙酰半乳糖胺(GalNAc)结合的siRNA药物,其Ⅱ期试验结果发表在The New England Journal of Medicine,可通过与肝脏中高表达的去唾液酸糖蛋白受体结合而具有肝脏靶向性。形成RNA诱导沉默复合物(RISC)后,其反义链靶向作用于HBV RNA,通过触发RNA干扰介导的HBsAg编码序列裂解,引起RNA降解。Xalnesiran靶向作用于几乎在所有HBV基因组中均存在的HBsAg编码区的病毒RNA序列并使其裂解;此外,任何重叠的病毒RNA种类也会发生降解,包括编码e抗原、核心抗原和病毒聚合酶的病毒RNA,以及病毒DNA基因组的前基因组RNA,最终降低HBsAg蛋白水平。
随着化学修饰和递送系统的进步,小核酸的特异性和有效性得以提高,且副作用减少。根据目标基因序列的信息可合理地设计靶向该基因序列的高特异性寡核苷酸先导化合物,因此,小核酸药物具有更高的药物开发效率、增强的靶向性与特异性。负载了siRNA引导链的RISC可以在体内循环,并与下一个靶标mRNA结合进行降解,因而可产生数月甚或更持久的效果,从而延长给药周期。这些特性均使siRNA和ASO药物为乙肝治愈带来新希望。
1.3 乙肝功能性治愈在ASO和siRNA时代成为短期可及的现实
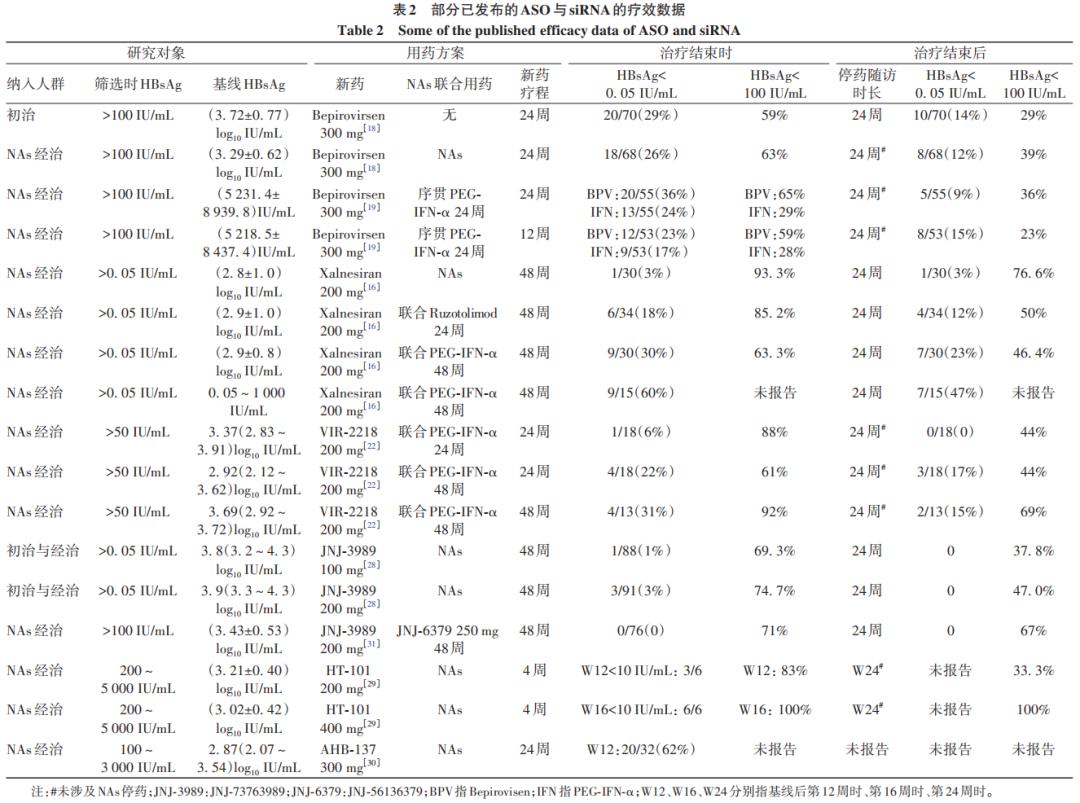
现有的已上市药物在普遍的乙肝人群的功能性治愈率为5%左右,长期NAs治疗对乙肝功能性治愈率的提升有限。一项纳入6 792例经41.3(7.6~107.6)个月NAs治疗的乙肝患者前瞻性队列研究中,后续经65.6(51.5~84.7)个月的治疗随访,HBsAg转阴的5年累积发生率仅为2.4%。相比之下,经过24周Bepirovirsen(每周300 mg)治疗结束时,29%的初治患者及26%的经治患者获得HBsAg转阴;结束治疗后24周,分别有14%与12%维持HBsAg阴性并获得功能性治愈。小核酸药物在有限疗程下实现的HBsAg转阴是跨越性的进步。将Bepirovirsen与PEG-IFN-α联合使用似乎并不能提高功能性治愈率。Bepirovirsen治疗24周或12周后序贯24周的PEG-IFN-α治疗,分别有9%(5/55)与15%(8/53)在结束治疗后24周维持HBsAg阴性,但这些患者均未停用NAs基础治疗;在Bepirovirsen 24周(组1)或12周(组2)治疗结束时,分别有36%(20/55)与23%(12/53)取得HBsAg转阴;随后序贯24周PEG-IFN-α治疗过程中,分别有40%(8/20)和42%(5/12)发生HBsAg复阳;当序贯的PEG-IFN-α治疗结束时,分别有24%(13/55)与17%(9/53)维持HBsAg阴性;PEG-IFN-α停药后24周,同时亦是Bepirovirsen停药后的48周,HBsAg复阳率为58%(组1)与0(组2),该研究提出序贯PEG-IFN-α治疗可能降低了Bepirovirsen治疗的复发率。上述研究提示,Bepirovirsen停药后的HBsAg复阳更集中发生于停药后的前24周,即使加用PEG-IFN-α治疗期间,HBsAg复阳仍在发生;而加用PEG-IFN-α治疗延缓了复发的发生使最终序贯治疗停药后24周的HBsAg转阴率与单用Bepirovirsen相当(9%~15%)。
与ASO单药相比,当前的siRNA单药暂未能达到同样高的HBsAg转阴率。为此,Piranga研究创新性通过平台研究设计,比较了联合或不联合免疫调节剂的Xalnesiran(一种siRNA)的疗效。研究纳入不设HBsAg上限的NAs经治人群,分别接受Xalnesiran 100 mg(组1)、Xalnesiran 200 mg(组2)、Xalnesiran 200 mg联合Ruzotolimod(Toll样受体激动剂)150 mg(组3)、Xalnesiran 200 mg联合PEG-IFN-α-2a 180 μg(组4)治疗48周。治疗结束时组1至组4分别有7%、3%、18%、30%获得HBsAg转阴;结束新药治疗后的24周与48周,组1至组4分别仍然有7%、3%、12%、23%与10%、0、12%、17%维持HBsAg阴性即功能性治愈。该概念验证性研究提示了siRNA与免疫调节剂联合治疗可获得更高的功能性治愈率。结束治疗后24周与48周,组1至组4分别有3%、0、3%、20%,以及3%、0、6%、17%取得HBsAg血清转换。Piranga平台研究的设计允许在不同时间灵活增加新的联合治疗组,均以共同的NAs单药组作为对照;Xalnesiran联合RO7191863(一种PD-L1锁核酸)的治疗方案则是最新开展的治疗组合。初步结果提示,Xalnesiran与RO7191863同时联合或序贯治疗时,分别有6.1%(2/33)与13.3%(4/31)获得治疗结束时HBsAg转阴,治疗结束后长期随访结果有待进一步观察。
VIR-2218(Elebsiran)是一种靶向HBV基因组X区的GalNAc siRNA,2次剂量即可使HBsAg显著下降。Yuen等探索了24周疗程的Elebsiran单药(组1)或分别联合12周PEG-IFN-α(组2)、24周PEG-IFN-α(组3)、48周PEG-IFN-α(组4),以及Elebsiran与PEG-IFN-α联合治疗均48周(组5)的疗效。结果发现,结束治疗时组2至组5,分别有7%(1/15)、6%(1/18)、22%(4/18)及31%(4/13)获得HBsAg转阴(共10例);在结束治疗后24周(NAs未停药),相应HBsAg转阴率分别为7%、0、17%、15%。上述结果提示,短疗程siRNA或siRNA单药治疗的HBsAg转阴率不如siRNA与PEG-IFN-α联合用药,但PEG-IFN-α的不良反应仍是值得关注的问题,研究中1例受试者因精神症状提前终止治疗并退出,而siRNA的良好耐受性则由于PEG-IFN-α的联合应用而有所下降。该研究发现试验期间共15例受试者曾发生HBsAg血清转换。抗-HBs<100 mIU/mL的3例均发生HBsAg复阳,而抗-HBs>500 mIU/mL的4例均维持停药后24周HBsAg阴性,抗-HBs水平100~500 mIU/mL的3例有1例维持HBsAg阴性、2例复阳。siRNA时代下,抗-HBs水平体现出更具波动性的特征并可能预测治疗应答,但在Bepirovirsen(ASO类药物)的Ⅱ期试验中,达到主要终点(功能性治愈)的患者,抗-HBs阳性率仅为50%(以>2 mIU/mL作为阳性值),提示抗-HBs阳性可能不是实现早期功能性治愈所必须的。
衣壳组装调节剂可有效降低HBV DNA与HBV RNA,并在临床前研究中观察到对乙肝病毒抗原的抑制。但令人意外的是,siRNA与衣壳组装调节剂联合使用并未能进一步降低HBsAg水平。AB-729与JNJ-73763989(后续简称JNJ-3989)均是早期被验证对HBsAg有明确作用的siRNA,前者与Vebicorvir、后者与JNJ-56136379(Bersacapavir)等衣壳组装调节剂同时联用,并未体现出增加的疗效,反而可能对HBsAg的下降有潜在拮抗作用。不过值得注意的是,前述研究对象中包括了当前未接受NAs治疗的HBeAg阳性的受试者。即使是ASO类药物Bepirovirsen亦在HBeAg阳性初治人群中表现欠佳,提示针对不同的乙肝人群可能需进一步采取不同的治疗策略。新近的国际会议报告中,HT-101(一种GalNAc结合的siRNA)400 mg间隔4周使用2次即可获得HBsAg平均最大下降量达3.29 log10 IU/mL。反义寡核苷酸AHB-137(300 mg,每周1次)针对基线HBsAg水平100~3 000 IU/mL的人群,治疗第12周时可使62%受试者获得HBsAg转阴。上述结果提示,随着研究人群的优化、小核酸类药物化学修饰等,可能会提高小核酸新药的疗效(表2)。
1.4 小核酸药物的优势人群
早期研发的个别siRNA药物因未能达到主要终点提前终止研究,或改变研发策略。这些先锋的研究促使研究者思考小核酸药物的优势人群,为后续的药物研发提供了策略性指引。此后的研究逐步证实低水平的HBsAg为小核酸药物治疗的优势人群。Bepirovirsen在基线HBsAg水平≤1 000 IU/mL的NAs经治人群中达到更高功能性治愈率(主要终点发生率16%)。而Bepirovirsen 12或24周序贯24周PEG-IFN-α治疗后,在基线HBsAg≤1 000 IU/mL的人群有更高的停药24周HBsAg转阴率(19%~50%)。采用Xalnesiran与PEG-IFN-α的联合治疗方案,针对HBsAg<1 000 IU/mL的人群,停药时与停药后48周分别有60%与33%患者获得HBsAg转阴,均提示HBsAg<1 000 IU/mL是小核酸新药疗效探索的优势分水岭。然而,在JNJ-3989(一种GalNAc修饰的siRNA)治疗48周的REEF-1与REEF-2研究中,未发现基线HBsAg水平与治疗应答的相关性,这两项研究中无受试者实现停药后24周的HBsAg转阴。Elebsiran(siRNA)的研究中,将第2~5治疗组汇总,在基线HBsAg≤3 000 IU/mL与HBsAg>3 000 IU/mL人群中,分别有11.1%(4/36)与7.1%(2/28)在结束治疗后HBsAg转阴,显示出基线HBsAg水平更低应答率更高的趋势;可能因样本量较小,该研究未展示以基线1 000 IU/mL为界值的HBsAg转阴率。
虽然HBsAg<1 000 IU/mL是小核酸新药疗效探索的优势分水岭,但这并不影响新药在获得初步疗效验证后,进一步探索其他人群的治疗策略。siRNA类药物JNJ-3989(Daplusiran/Tomligisiran)由两个触发器组成:S触发器JNJ-73763976,靶向所有S开放阅读框mRNA,包括源自整合DNA和cccDNA衍生转录物的转录物,以及X触发器JNJ-73763924,靶向存在于所有cccDNA衍生转录物中的X开放阅读框mRNA。有研究者计划探索siRNA(JNJ-3989)与ASO(Bepirovirsen)序贯治疗在高HBsAg水平与低HBsAg水平的经治乙肝患者中的疗效,纳入人群HBsAg>100 IU/mL不设上限(NCT06537414)。siRNA和ASO的强强联合是否能进一步解决全乙肝人群的功能性治愈有待时间验证。
2小核酸新药在HBsAg转阴之外的其他考量
国际专家共识建议乙肝新药的功能性治愈率在6个月到1年有限疗程后应达30%以上,以满足上市后的临床需求。虽然目前针对全乙肝人群的30%治愈率仍是各种乙肝新药暂时难以企及的目标,但在siRNA结束治疗后的长期随访中,有令人鼓舞的发现。研究人员观察了53例乙肝受试者在接受4次剂量ARC-520或3次剂量JNJ-3989的短期治疗停药后,在平均52.5个月的长期随访中,仍有32.1%可维持HBsAg<100 IU/mL,而安慰剂组(NAs治疗)则为0。因此,未来值得关注的问题是有限疗程结束后HBsAg水平长期维持<100 IU/mL可否转化为肝脏事件或HCC事件减少,功能性治愈是否能在超过24周或48周的更长时间维持,从而真正达到提高生存率与生活质量的治疗目的。
在小核酸类新药24~48周的有限疗程结束时,59%~93%经治患者达到HBsAg<100 IU/mL(表2),结束治疗24周以后仍有36%~77%可远期维持HBsAg<100 IU/mL;与此相比,NAs经治乙肝患者,经中位时间65.5个月治疗随访,14.1%~21.5%分布在HBsAg<100 IU/mL。HBsAg水平<100 IU/mL可能是乙肝免疫控制的关键分水岭,该状态可在一部分乙肝患者中相对稳定地维持,而既往研究亦提示HBsAg<100 IU/mL与NAs停药后持续病毒学应答相关。HBsAg对血液和肝脏中免疫细胞亚群基因表达水平有一定的影响;那么有限疗程小核酸药实现的HBsAg下降,是否可恢复针对HBV和感染细胞的宿主免疫应答并诱导HBsAg长久血清清除也是值得关注的问题。已有研究对该问题进行了初步的探索。在两项JNJ-3989相关临床研究中,对HBeAg阴性患者进行的血清蛋白质组学分析显示,JNJ-3989治疗可降低可溶性Fas配体(FasL)水平,使血清中肝细胞相关蛋白水平升高,提示免疫介导的肝细胞凋亡有所增加。由于可溶性FasL能够通过空间位阻干扰膜结合型Fas/FasL相互作用,进而阻碍细胞毒性T淋巴细胞/自然杀伤细胞的促凋亡作用,这些数据表明,JNJ-3989治疗或许可通过恢复Fas/FasL介导的凋亡信号传导,增强细胞毒性免疫细胞对受感染肝细胞的清除能力。另一方面,采用流式细胞技术数据进行高维分析既往接受Bepirovirsen治疗的患者,与无应答者相比,有应答者的初始B淋巴细胞、CD56dim自然杀伤细胞以及终末分化的效应记忆CD8+T淋巴细胞在治疗后的数量有所增加。虽然暂未阐明免疫学状态的改变促进了治疗应答发生,还是药物治疗应答诱导HBV相关免疫恢复,但小核酸药物治疗后免疫学的相关研究将利于乙肝治愈策略的优化。
乙肝新药试验中NAs的停药标准暂没有形成广泛的共识。既往曾有研究提示低水平HBsAg在NAs停药后可能利于宿主HBV特异性免疫恢复,由此一些研究延迟NAs再治疗以期观察停药后的HBsAg进一步下降或转阴。基于Xalnesiran联合治疗方案的Piranga研究还探索了NAs停药的可行性与安全性。该研究设置了特定的NAs停药标准,即在完成48周基于Xalnesiran联合治疗的有限制疗程后,同时满足(1)ALT<1.25倍基线水平;(2)HBV DNA<20 IU/mL;(3)HBeAg阴性;(4)HBsAg<0.05 IU/mL或HBsAg较基线下降大于1 log10时符合<100 IU/mL。纳入研究的121例乙肝受试者经过48周Xalnesiran相关的联合治疗后,58例(48%)达到NAs停药标准,其中40例按方案停用NAs,其余18例未进行NAs停药。NAs停药的40例受试者中,24例(60%)可维持停药稳定,17例(43%)达到NAs再治疗标准而16例重新启用NAs治疗。NAs再治疗标准为(1)HBV DNA>20 000 IU/mL,或(2)HBV DNA>2 000 IU/mL且ALT>1.5倍正常值上限,或(3)HBV DNA>2 000 IU/mL经隔周复查确认,或(4)肝功能下降的临床症状或实验室检查。NAs停药的受试者接受了密切的监测,在前3个月每2周复查1次,随后每个月复查1次,并可据需要增加复查次数。NAs停药的40例受试者中,5例(13%)维持了HBsAg转阴且HBV DNA<10 IU/mL并一直停药;这5例受试者均接受过Xalnesiran加免疫调节剂的联合治疗方案。在结束治疗后48周随访时,仍有高达83% NAs停药者维持HBsAg<100 IU/mL。病毒学复发发生在19例(48%)受试者中,而仅有3例(8%)发生生化学复发。生化学复发的3例受试者均不伴胆红素升高,且在重启NAs治疗后得到恢复。Piranga研究体现了密切监测下NAs停药的安全性与可行性。
3展望
利用乙肝患者NAs治疗随访期间的多时间点HBsAg数据,Fan等构建并验证了新型的、精准的乙肝功能性治愈预测模型(GOLDEN评分),将患者分为优势人群(占总人群8.5%~10.4%)和非优势人群(占总人群89.6%~91.5%)。其中,优势人群的5年功能性治愈累积发生率为17.0%~29.1%,而非优势人群中无人实现功能性治愈。GOLDEN评分有待推广验证于NAs之外的不同机制药物作用下HBsAg的动态变化。乙肝新药作用下HBsAg的轨迹分析可为个体化治疗、预测疗效及优化治疗策略提供重要的依据。
NAs的长期治疗后超一半患者达到HBsAg<1 000 IU/mL;联合或序贯小核酸药物治疗可显著缩短HBsAg演化进程,使超60%达到HBsAg<100 IU/mL;通过NAs停药后低水平的HBV DNA或抗原水平以刺激宿主HBV特异性免疫恢复和等待功能性治愈的发生,可能并不是最高效的途径,并可能带来肝炎复发的风险。与其等待,不如主动干预。对于小核酸药物等创新药治疗后达到HBsAg<100 IU/mL的患者,仍是新药研发的重要对象。未来乙肝的治愈可能是不同机制新药针对不同HBsAg界值人群的各施其职、各展所长的序贯或同时联合策略。

https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH250102
梁携儿, 刘智泓, 侯金林. 乙型肝炎功能性治愈新药:聚焦反义寡核苷酸和小干扰RNA[J]. 临床肝胆病杂志, 2025, 41(1): 7-14

全网首发|《临床肝胆病杂志》2025年第1期“慢性乙型肝炎的功能性治愈”重点号(执行主编:庄辉)
述评|庄辉院士:慢性乙型肝炎功能性治愈不是梦
指南推荐|2024年亚太肝病学会推荐意见:非肝硬化门静脉纤维化/特发性门静脉高压的诊断和管理
作者须知|不要相信这些“添加编辑微信”的邮件!

- 随机文章
- 热门文章
- 热评文章
- 对乙酰氨基酚肝毒性的评估与治疗丨临床必备
- 杭州日报:一位体育老师的一周观察——课间15分钟实施后有哪些
- 同江口岸持续上新冲刺新年开门红
- 飙到22℃后马上大转折:济南本周雨雨雨,大风降温也连着来今
- 家人们,这类菜真的可能致癌,建议少吃!
- 南京师范大学通报:教师宋某某涉嫌师德失范,免去环境学院副院
- 突发火情!南京江宁发布通报
- 湖南省岳阳市水务集团有限公司党委书记、董事长李宇宙接受审查
转载请注明来自知行看点,本文标题:《专家论坛|梁携儿侯金林:乙型肝炎功能性治愈新药——聚焦反义》














 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号